Forsøker å sette meg litt inn i vannjusteringer og merker jeg ikke helt får det til å henge på greip.
Første går egentlig mest på brewfather software.
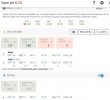
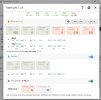
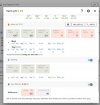
Er jeg på riktig spor hvis jeg går inn på profile > water og endret default?
Så, når jeg da skal brygge en oppskrift, er da alle oppskrifter justert etter denne defaulten? Eller er det noe jeg må aktivere / huke av eller liknende for å få disse justeringene automatisk?
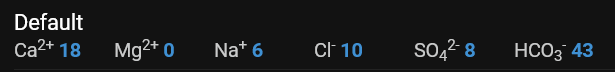
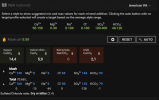
Det andre er faktisk tallene, nå har jeg endret defaulten til noe jeg trodde var riktig. Det medfører at jeg har ødelagt default settingene, fant ut at man kunne lage en egen profil for source/kilde senere.
Deretter fant jeg ut at omregning av tall jeg fikk, som ikke nødvendigvis er 1 > 1 omregning slik noen artikler mente.
Så, hva putter jeg egentlig inn som tall?
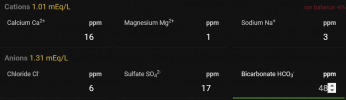
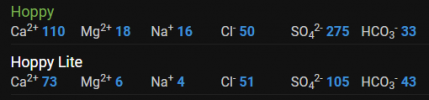
Fikk dette som vannprofil da jeg forespurte, står også at enkelte av verdiene er hentet fra Oslo kommunes rapport, da Ski-området kjøper vann derfra. Mulig Oslo og Ski har identisk vannprofilrapport, men her er iallfall tallene.
Kalsium: 16mg/L
Magnesium 0,5mg/L
Natrium: 2-2,5 mg/L
Klorid 6-9mg/L
Sulfat: 17 mg/L
pH: 7,5-7,9
Bikarbonat var ikke målt da jeg fikk svar det var bare vanlig å analysere på kullsyreholdig vann på flaske.
Første går egentlig mest på brewfather software.
Er jeg på riktig spor hvis jeg går inn på profile > water og endret default?
Så, når jeg da skal brygge en oppskrift, er da alle oppskrifter justert etter denne defaulten? Eller er det noe jeg må aktivere / huke av eller liknende for å få disse justeringene automatisk?
Det andre er faktisk tallene, nå har jeg endret defaulten til noe jeg trodde var riktig. Det medfører at jeg har ødelagt default settingene, fant ut at man kunne lage en egen profil for source/kilde senere.
Deretter fant jeg ut at omregning av tall jeg fikk, som ikke nødvendigvis er 1 > 1 omregning slik noen artikler mente.
Så, hva putter jeg egentlig inn som tall?
Fikk dette som vannprofil da jeg forespurte, står også at enkelte av verdiene er hentet fra Oslo kommunes rapport, da Ski-området kjøper vann derfra. Mulig Oslo og Ski har identisk vannprofilrapport, men her er iallfall tallene.
Kalsium: 16mg/L
Magnesium 0,5mg/L
Natrium: 2-2,5 mg/L
Klorid 6-9mg/L
Sulfat: 17 mg/L
pH: 7,5-7,9
Bikarbonat var ikke målt da jeg fikk svar det var bare vanlig å analysere på kullsyreholdig vann på flaske.