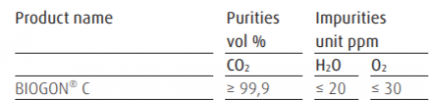Finn Berger
Moderator
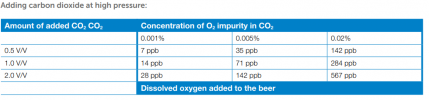
Hverken vørter eller øl bør komme mer i kontakt med luft enn høyst nødvendig - og helst ikke i det hele tatt, med unntak for oksygeneringa ved gjæringsstart, sjølsagt. Særlig gjelder det ølet på den kalde sida, mens det er omdiskutert hvor alvorlig det er på den varme sida.
At oksygen kan ødelegge øl er det ingen tvil om, og jeg mener ikke å si at det ikke er smart å alltid søke å begrense luftkontakten. På den annen side har jeg en følelse av at angsten for okysgenet kan være en smule overdrevet. Jeg har brygga såpass mye øl der jeg har brutt med de strengeste reglene uten at det har fått katastrofale konsekvenser, at jeg har kommet til å undre på om det ikke er mulig å komme ganske langt med moderate forholdsregler. Vi trenger kanskje ikke unngå all kontakt med luft?
Et spørsmål jeg ikke har funnet noe godt svar på, er hvor viktig kontakttid der. Når jeg flasker, f.eks., kommer ølet i kontakt med luft i flaska mens den fylles. Men det tar ikke lang tid. Og hvor farlig er det egentlig?
At oksygen kan ødelegge øl er det ingen tvil om, og jeg mener ikke å si at det ikke er smart å alltid søke å begrense luftkontakten. På den annen side har jeg en følelse av at angsten for okysgenet kan være en smule overdrevet. Jeg har brygga såpass mye øl der jeg har brutt med de strengeste reglene uten at det har fått katastrofale konsekvenser, at jeg har kommet til å undre på om det ikke er mulig å komme ganske langt med moderate forholdsregler. Vi trenger kanskje ikke unngå all kontakt med luft?
Et spørsmål jeg ikke har funnet noe godt svar på, er hvor viktig kontakttid der. Når jeg flasker, f.eks., kommer ølet i kontakt med luft i flaska mens den fylles. Men det tar ikke lang tid. Og hvor farlig er det egentlig?