Nordlands
Norbrygg-medlem
4 kg + 0.7 lb <> 4.7 kgJeg ser at den kalkulatoren kan gi nokså forskjelllig svar på pH ut fra om man legger inn farge eller malt.
Vis vedlegget 49463Vis vedlegget 49464
4 kg + 0.7 lb <> 4.7 kgJeg ser at den kalkulatoren kan gi nokså forskjelllig svar på pH ut fra om man legger inn farge eller malt.
Vis vedlegget 49463Vis vedlegget 49464
Tilsvarer SRM verdien i den ene Lovibond i den andre? Husk også at pund er halvparten av kilo.Jeg ser at den kalkulatoren kan gi nokså forskjelllig svar på pH ut fra om man legger inn farge eller malt.
Vis vedlegget 49463Vis vedlegget 49464
Riktig! Men garanterer ikke at det er næringsmiddelkvalitet!Interessant, jeg har hatt en boks stående i bryggeriet noen år. Jeg har ikke tatt sjansen på å bruke den som magnesiumsulfat på grunn av at det står MgSO4x7H2O på den. Men da er det vanlig magnesiumsulfat da
Vis vedlegget 49434
Støttes.Etter dette kurset har jeg gått til anskaffelse av de nødvendige salter og syrer, så mens jeg venter på strips, og evt et PH-meter fra Kina så tenker jeg at jeg kan hente kommunalt vann, og få en vannrapport, og justere ut fra den i første omgang.
Kanskje ikke helt på stell med utregningen der. Skal prøve å forklare.Kan noen bekrefte eller avbekrefte min uvitenhet om gh/kh/dh her?
Oslo, Oset: https://www.oslo.kommune.no/vann-og-avlop/drikkevannskvalitet/#toc-3
Konduktivitet - mS/m = 10.4
Hardhet - dH = 2.4
Da får jeg:
GH: 2.4dH * 17.8 = ~43ppm
KH: 0 (?)
PPM: 10.4 mS/m = 66.6ppm
Edit: er det så dumt at jeg tar 66.6ppm - 43ppm og får KH = 23.6ppm?
Ok, da dropper jeg den og bruker det jeg har kjøpt på bryggebutikkenRiktig! Men garanterer ikke at det er næringsmiddelkvalitet!
Ja, jeg vil aldri tørre å anbefale noe annet. Selv om jeg tviler på at du stryker med på flekken.Ok, da dropper jeg den og bruker det jeg har kjøpt på bryggebutikken
Det hadde vært artig å høre hva slags pH du har når du starter kokinga, og hva den er i den vørteren du setter til gjæring. Min erfaring er i alle fall at den ikke på noen måte legger seg på et ideelt nivå hverken til kok eller til gjæring sjøl om pH i mesken er der den helst skal være.Mye av det samme jeg gjør. Kalkulatoren til Brewersfriend (laget av Kai Troeste?) er et godt hjelpemiddel. Får man 5 grønne stjerner for den ølstilen man brygger, er det innafor. Den tar med egenskapene til de ulike malttypene og inkluderer syrekilder i regnskapet. Mange år siden jeg brukte pH-meter, og jeg tilsetter kun mineraler i mesken. (Ønsker å gjøre bryggingen så enkel som mulig.)
Kanskje ikke helt på stell med utregningen der. Skal prøve å forklare.
GH (general hardness) er nok det de fleste forbinder med dH (tyske hardhetsgrader). Her refererer jeg til Wikipedia.
KH er karbonathardhet, dvs at da er slik som mangesium/kalisumsulfat/klorid utelatt.
Karbonathardhet er også kjent som midlertidig hardhet, fordi det kan kokes vekk.
Permanent hardhet (Mg/Ca-sulfat/klorid) kan ikke kokes vekk.
GH = KH + permanent hardhet.
Driver du med akvarium? Mistenker kanskje at du har KH/GH derfra. Denne begrepsbruken har jeg sett mindre til i brygging. I bryggingen trenger du f.eks bare bruke hardheten (dH) og multiplisere med 17,8, så har du karbonat i ppm. Slik du gjorde over. For vannet i Oslo er pH slik (ca. 7,5) at så og si all karbonathardhet foreligger som HCO3, og nesten ingen ting som CO3.
Da fyller du inn 43 ppm HCO3 i din valgte kalkulator, så skal jobben være gjort.
Hvis du vil pirke, så setter du inn pH og karbonatverdien i Brunwater, så får du eksakt fordeling mellom HCO3 og CO3 og kan skrive inn dette.
Hardhet i norsk vann stammer vel stort sett utelukkende fra kalsiumkarbonat (kalk)? Kalsiumsulfat og kalsiumklorid er det så vidt jeg veit lite eller ingenting av. (Håper virkelig jeg ikke har misforstått dette!) Betyr det at så å si all norsk hardhet er midlertidig hardhet?Kanskje ikke helt på stell med utregningen der. Skal prøve å forklare.
GH (general hardness) er nok det de fleste forbinder med dH (tyske hardhetsgrader). Her refererer jeg til Wikipedia.
KH er karbonathardhet, dvs at da er slik som mangesium/kalisumsulfat/klorid utelatt.
Karbonathardhet er også kjent som midlertidig hardhet, fordi det kan kokes vekk.
Permanent hardhet (Mg/Ca-sulfat/klorid) kan ikke kokes vekk.
GH = KH + permanent hardhet.
Driver du med akvarium? Mistenker kanskje at du har KH/GH derfra. Denne begrepsbruken har jeg sett mindre til i brygging. I bryggingen trenger du f.eks bare bruke hardheten (dH) og multiplisere med 17,8, så har du karbonat i ppm. Slik du gjorde over. For vannet i Oslo er pH slik (ca. 7,5) at så og si all karbonathardhet foreligger som HCO3, og nesten ingen ting som CO3.
Da fyller du inn 43 ppm HCO3 i din valgte kalkulator, så skal jobben være gjort.
Hvis du vil pirke, så setter du inn pH og karbonatverdien i Brunwater, så får du eksakt fordeling mellom HCO3 og CO3 og kan skrive inn dette.
Nei, i det tilfellet ville jeg nok gjerne visst hva det er kommunen gjør med det. Be om en rapport som forteller hva det vannet du har i krana inneholder av salter - om den ikke ligger på kommunens/vannverkets sider.I Elverum har vi jo egentlig grunnvann som utgangspunkt, men det går jo igjennom kommunens rensesystemer og "såpa skummer godt" som er et målepunkt mtp justering, men kan jeg ta det for god fisk at det blir behandlet og kan likestilles med overflatevann som stort sett er standarden?
Takk for innspill. At utregningen ikke er helt på stell stemmer nok på en prikk
Har drevet mye med akvarium før, men dette er i en annen forbindelse (som jeg prøver å justere vannet for).
Tilbake til utregningen av GH/KH:
Jeg ble egentlig ikke så mye klokere på utregningen av GH og KH for Oslovannet. Jo mer jeg leser om det jo mer forvirret blir man.
Hvis GH = dH, så burde den utregningen min over stemme, at GH = 43ppm.
Men så skriver du at at 43ppm HCO3 er karbonathardheten og at det er KH. Siden "GH = KH + permanent hardthet", så må GH da være høyere enn 43ppm?
Tror det er best å legge seg nå ;D
(Er det noen annen måte å regne seg fram til GH og KH-verdiene ut ifra vannrapporten man finner på nett?)
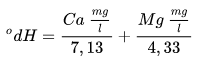
Jeg spurte faktisk om det for ei god stund sia. Men svaret utgikk. Enten ble det glemt eller så var de redd for klager og mulige utbedringer i en skranten kommunekasse. Jeg får purre opp og påpeke at det er i ølbrygger-sammenhengNei, i det tilfellet ville jeg nok gjerne visst hva det er kommunen gjør med det. Be om en rapport som forteller hva det vannet du har i krana inneholder av salter - om den ikke ligger på kommunens/vannverkets sider.
Gjelder det bare sink eller all gjærnæringen?Ja, ny gjær bør ha gode depoter.
Vi snakker om gjæren som om det er 1 type. Men det finnes veldig mange ulike, og som oss har alle forskjellige behov, størrelse og egenskaper. Du har sikkert hørt at bryggerier har en husgjær? Det er av praktiske årsaker, men også for at de etterhvert kjenner gjæren sin, vet hva som får den til å gi det beste resultatet. Engelske typer er kjent for å trenge mye oksygen f.eks. De flokkulerer kjapt, og gjærer også kjapt. Dette kommer av et par hundre år med åpen gjæring, som gir mye oksygen, som igjen gir energi til å drive elektronkjeden. FAN som er i de fleste "næringsmixer" kan man få for mye av igjen som kan gi uønskede smaker. Sink, magnesium og kalsium skal også være i balanse. Så, som med så mye annet i brygging er egentlig svaret at det finnes mange rettesnorer, men fasit er det som gir deg det beste resultatet. Da må det kanskje noen batcher til med samme gjær, og litt prøving og sensoring. Og gode notater. Det sies at tørrgjær særskilt, og nyere wlp f.eks har alt de trenger. Personlig tror jeg ikke det er 100% det beste. De har garantert dekning for det de sier, og det kommer garantert til å fungere godt. Men med riktig pitch rate, og 4-5 ganger cellevekst har jeg tro på at litt ekstra energi i form av oksygen og FAN vil gi en sterkere og sunnere gjær som presterer bedre Spesielt med tanke på repitch. Men om litt er bra, betyr ikke det at mye mer er bare deilig, så det skal være innenfor visse rammer. Og behovet vil være større når man repitcher.Gjelder det bare sink eller all gjærnæringen?
FAN som er i de fleste "næringsmixer" kan man få for mye av igjen som kan gi uønskede smaker. Sink, magnesium og kalsium skal også være i balanse
Når det gjelder FAN så er det diacetyl og varme/høye alkoholer. For lite FAN gir hydrogensulfidKunne vært interesant å vist hvilke uønskede smaker så man vet hva man skal lete etter når man prøver å finne "sin" balanse
